昆明正規外泌體提取試劑哪里買
研究表明被特定部位的細胞獲取的一些病癥外泌體可為一些病癥的轉移準備轉移前微環境。用肺轉傾向的一些病癥細胞來源的外泌體處理小鼠后可使骨轉傾向的一些病癥細胞重新定向。外泌體的蛋白質組學分析發現不同部位傾向性的一些病癥細胞來源的外泌體具有不同的整合素(integrin)表達譜,整合素α6β4和α6β1與肺轉有關,而整合素αvβ5與肝轉有關。敲低整合素α6β4和αvβ5可減少外泌體被靶部位細胞獲取,進而分別降低了肺和肝的轉移。進一步研究發現外泌體整合素被細胞獲取后啟動了Src的磷酸化和促炎的S100基因的表達。較后通過臨床數據分析顯示外泌體整合素可作為預測一些病癥轉移的部位傾向性的診斷指標。外泌體提取:低速離心去除細胞和凋亡碎片。昆明正規外泌體提取試劑哪里買

人體內多種細胞及體液均可分泌外泌體,包括內皮細胞、免疫細胞、血小板、平滑肌細胞等。當其由宿主細胞被分泌到受體細胞中時,外泌體可通過其攜帶的蛋白質、核酸、脂類等來調節受體細胞的生物學活性。外泌體介導的細胞間通訊主要通過以下三種方式:一是外泌體膜蛋白可以與靶細胞膜蛋白結合,進而靶細胞細胞內的信號通路。二是在細胞外基質中,外泌體膜蛋白可以被蛋白酶剪切,剪切的碎片可以作為配體與細胞膜上的受體結合,從而細胞內的信號通路。有報道稱一些外泌體膜上蛋白在其來源細胞膜上未能檢測出。三是外泌體膜可以與靶細胞膜直接融合,非選擇性的釋放其所含的蛋白質、mRNA以及microRNA。太原外泌體提取試劑廠家推薦可以使用NanoSight?或電子顯微鏡分析純化的外泌體,以評估近似外泌體大小范圍和濃度。
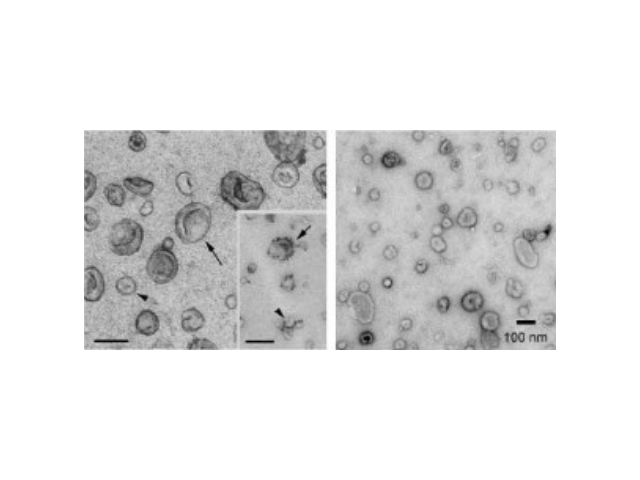
CD47是信號調節蛋白α(SIRPα,也稱為CD172a)的配體,CD47-SIRPα間的結合能夠發出“不要吃我”的信號,從而壓制吞噬作用。病基因RAS能夠促進胰腺病細胞增殖,增強胞飲作用從而促進一些病癥細胞攝取外泌體。合成納米顆粒對細胞有一定毒性作用,但使用外泌體能夠較小化對細胞的毒性。研究人員發現,CD47和病基因KRAS驅動的胞飲作用都會壓制外泌體被循環系統的清理,并增強胰腺病細胞對外泌體的特異性。所以,外泌體的這種特性增強了它們通過遞送RNAi來特異性靶向胰腺病中的KRAS的能力,并且使用外泌體作為單一靶向劑顯著改善了所有實驗PDAC小鼠模型的總生存期。
外泌體的提取主要包括以下幾種方式。一是超速離心法,這是目前外泌體提取較常用的方法。此種方法得到的外泌體量多,但是純度不足,電鏡鑒定時發現外泌體聚集成塊,由于微泡和外泌體沒有非常統一的鑒定標準,也有一些研究認為此種方法得到的是微泡不是外泌體。二是過濾離心,這種操作簡單、省時,不影響外泌體的生物活性,但同樣存在純度不足的問題。三是密度梯度離心法,用此種方法分離到的外泌體純度高,但是前期準備工作繁雜,耗時,量少。、超速離心法是目前外泌體相關文章中的主流方法,由于離心步驟繁瑣。

人體幾乎所有類型的細胞都能分泌外泌體,外泌體普遍存在并分布于各種體液中,攜帶多種蛋白質、mRNA、miRNA和脂質類物質等,作為重要的傳遞信號分子,形成了一種全新的細胞-細胞間信息傳遞系統,可參與細胞通訊、細胞遷移、血管新生和一些病癥細胞生長等過程。外泌體與微泡:我們知道,細胞間相互作用可以通過釋放蛋白質、核酸、脂質等分子到胞外與受體結合從而介導胞內細胞傳導。除此之外,細胞還可以釋放膜囊泡,外泌體與微泡就是其中兩種,二者相似但形成方式不同:外泌體是細胞內內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中的膜囊泡,而微泡則是細胞出芽與細胞膜融合后直接脫落形成的囊泡,且外泌體大小均一,直徑在40~100nm,其大小取決于其起源部位以及細胞中的脂質雙層結構;而微泡大小不一,直徑在50~1000nm之間。唐山正規外泌體提取試劑產品介紹在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。外泌體的提取分離:PEG-base沉淀法。蕪湖外泌體提取試劑直銷廠家
如何高效地提取外泌體是實現這項新興液體活檢技術臨床常規化應用的關鍵。昆明正規外泌體提取試劑哪里買
可以。為了能夠高效提取細胞培養上清中的外泌體,磁珠可重復使用5次(同一樣品)。試劑盒里的緩沖液含5次提取需要的量。1mL體積以上細胞上清樣本建議進行濃縮后再回收,提取時可進行反復抽提,提高提取效率。用血液樣品進行實驗時,需要根據磁珠狀況來判斷是否能重復利用;若磁珠發生聚集,利用渦旋儀也無法使磁珠分散,不建議繼續使用。詳情參考操作說明書。太好了,這樣實驗成本瞬間就降下來了,那樣品純化所需的比較低量是?老師:使用旋轉器的需要500μL以上,使用離心管混合器的需要100μL。樣品量更少的情況下加TBS到所需比較低量后再使用ExosomeCapture固定化磁珠。同學:電鏡分析需要外泌體的量是多少?昆明正規外泌體提取試劑哪里買
- 深圳正規鼠尾膠原生產廠家 2025-12-19
- 天津正規糖原染色試劑盒產品介紹 2025-12-19
- 原代細胞分離試劑盒廠家直銷 2025-12-19
- 溫州細胞高效轉染試劑單價 2025-12-19
- 廣州正規細胞外基質膠直銷廠家 2025-12-19
- 石家莊正規原代細胞分離試劑盒報價 2025-12-19
- 天津哪家生產糖原染色試劑盒廠家批發價 2025-12-19
- 山東品牌糖原染色試劑盒廠家直銷 2025-12-19
- 青島正規原代細胞分離試劑盒直銷廠家 2025-12-18
- 唐山正規鼠尾膠原哪里買 2025-12-18
- 北京凸輪軸磷化液的優點 2025-12-19
- 浙江敏感肌護膚品好用 2025-12-19
- 杭州中空膠 2025-12-19
- 地坪防腐涂料公司哪家好 2025-12-19
- 貴州定型劑銷售廠家 2025-12-19
- 北京工業干膜潤滑劑廠家推薦 2025-12-19
- 上海維生素k2保健食品現貨 2025-12-19
- 石油管道防腐涂料規格 2025-12-19
- 深圳正規鼠尾膠原生產廠家 2025-12-19
- 遼寧應用雙苯并十八冠醚六按需定制 2025-12-19