南京正規外泌體提取試劑
外泌體的提取、分離方法:微流控技術。微流控是利用微納米級尺寸的管道來處理和操控流體所涉及的一門技術,其在外泌體分離方面的應用受到越來越多學者的關注。Jie等[16]課題組開發了一種三維納米結構微流控芯片,微柱陣列通過化學沉積將交叉多壁碳納米管功能化,然后其就可以識別特定的分子(CD63)并利用獨特拓撲納米材料高效的捕獲外泌體。Wunsch等[17]利用硅工藝生產納米級確定性側向位移(Nano-DLD)芯片,得到了均勻的間隙尺寸,該芯片可以靈敏地將20~110nm的顆粒分離。該研究證明了外泌體基于大小的位移,從而揭示了利用芯片分選和量化納米級生物膠體的潛力。外泌體提取:回收率不穩定(可能與轉子類型有關),純度也受到質疑。南京正規外泌體提取試劑

由于外泌體的特殊結構和功能,使得它具有潛在的應用價值,一方面可以作為診斷多種疾病的生物指標,另一方面也可以作為治病手段,未來有可能作為藥物的天然載體用于臨床治病。外泌體的分離純化一直是科研工作者關注的問題,獲得高純度的外泌體對后續的研究至關重要。據了解,目前人們多采用超速離心、免疫磁珠、超濾、沉淀或試劑盒等方法實現外泌體的提取分離。外泌體攜帶大量特異性的蛋白質(如細胞因子、生長因子)以及功能性的mRNAs、miRNAs等生物活性物質,在體內參與細胞通訊、細胞遷移、促血管新生和抗一些病癥免疫等生理過程,與多種疾病的發生和進程密切相關。南昌外泌體提取試劑推薦廠家人尿液來源細胞的外泌體的獲取方法,是首先分離培養人尿液來源細胞并收集培養基。
外泌體的提取方法:1.超速離心法(差速離心)。超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎,但過程比較費時,且回收率不穩定(可能與轉子類型有關),純度也受到質疑;此外,重復離心操作還有可能對囊泡造成損害,從而降低其質量。2.密度梯度離心。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感。
外泌體的提取主要包括以下幾種方式。一是超速離心法,這是目前外泌體提取較常用的方法。此種方法得到的外泌體量多,但是純度不足,電鏡鑒定時發現外泌體聚集成塊,由于微泡和外泌體沒有非常統一的鑒定標準,也有一些研究認為此種方法得到的是微泡不是外泌體。二是過濾離心,這種操作簡單、省時,不影響外泌體的生物活性,但同樣存在純度不足的問題。三是密度梯度離心法,用此種方法分離到的外泌體純度高,但是前期準備工作繁雜,耗時,量少。外泌體檢測作為一種新型的液體活檢熱點技術已被許多臨床科研機構普遍地應用于一些病癥和疾病的無創診斷外泌體提取:重復離心操作還有可能對囊泡造成損害,從而降低其質量。

外泌體的提取主要包括以下幾種方式。一是超速離心法,這是目前外泌體提取較常用的方法。此種方法得到的外泌體量多,但是純度不足,電鏡鑒定時發現外泌體聚集成塊,由于微泡和外泌體沒有非常統一的鑒定標準,也有一些研究認為此種方法得到的是微泡不是外泌體。二是過濾離心,這種操作簡單、省時,不影響外泌體的生物活性,但同樣存在純度不足的問題。三是密度梯度離心法,用此種方法分離到的外泌體純度高,但是前期準備工作繁雜,耗時,量少。、外泌體提取:免疫分離技術。南京正規外泌體提取試劑
外泌體提純試劑盒的特色與優勢:外泌體被純化并且不含任何其他RNA結合蛋白。南京正規外泌體提取試劑
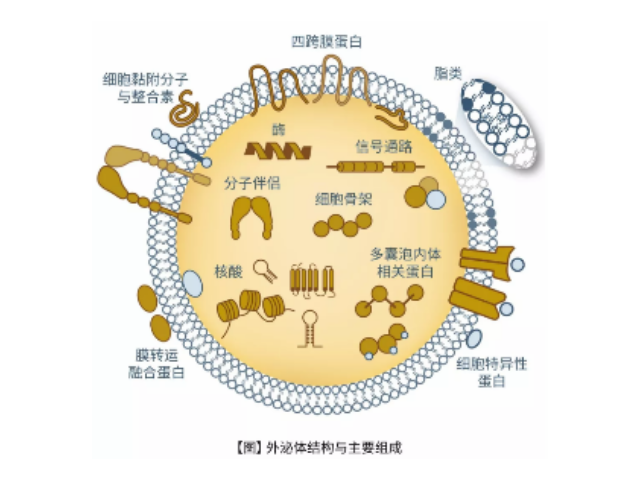
外泌體(Exosome)是由細胞分泌而來的微小囊泡,直徑約為30-200nm,密度在1.13-1.21g/ml,具有杯狀形態、雙層膜結構,天然存在于血液、尿液、唾液、母乳和細胞培養基等生物體液中。包括瘤細胞在內幾乎所有類型的細胞(免疫細胞、神經細胞、干細胞),都可以產生并釋放exosome。Exosome內含有與細胞來源相關的蛋白質rRNA和microRNA,Exosome可通過細胞膜受體直接受體細胞,也可運輸蛋白質、mRNA、miRNA、lncRNA、circRNA,甚至細胞器進入受體細胞,參與細胞間通訊。Exosome在免疫應答、炎癥反應、血管生成、凋亡、凝血和廢物處理等生理過程發揮關鍵作用,不同細胞來源的exosome所含有的RNA和蛋白成分不盡相同,可作為多種疾病的早期診斷標記物,也能作為靶向藥物的載體進行疾病南京正規外泌體提取試劑
- 廈門正規細胞高效轉染試劑銷售廠家 2025-12-19
- 蕪湖正規細胞高效轉染試劑報價 2025-12-19
- 天津如何使用糖原染色試劑盒廠家供應 2025-12-19
- 深圳正規鼠尾膠原生產廠家 2025-12-19
- 江蘇如何使用糖原染色試劑盒廠家供應 2025-12-19
- 徐州鼠尾膠原直銷價 2025-12-19
- 唐山鼠尾膠原哪家便宜 2025-12-19
- 溫州正規原代細胞分離試劑盒產品介紹 2025-12-19
- 天津正規糖原染色試劑盒產品介紹 2025-12-19
- 石家莊原代細胞分離試劑盒產品介紹 2025-12-19
- 北京進口微高力喹吖啶酮類顏料 2025-12-19
- 遼陽應用環氧富鋅底漆量大從優 2025-12-19
- 湖北使用實驗室超純水儀價目表 2025-12-19
- 遼寧國產替代磁芯粘接膠TDS手冊 2025-12-19
- 蕪湖正規細胞高效轉染試劑報價 2025-12-19
- 水性防腐涂料種類 2025-12-19
- 混凝土防腐涂料公司有哪些 2025-12-19
- 長安鎮促裕新材料銷售廠家 2025-12-19
- 湖南耐高低溫工程橡膠液壓系統密封 2025-12-19
- 復配實驗室蒸餾水牌子 2025-12-19