廈門外泌體提取試劑廠家
外泌體項目獲批學科方向:從統計來看,與前年相似外泌體立項集中的領域還是一些病癥學,近年來外泌體發表的文章也絕大部分與其在一些病癥的形成,耐藥性,檢測等方面有關。例如2019年發表在MolecularCancer(IF=10.679)上的文章表明外泌體FMR1-AS1通過TLR7/NFκB/c-My信號通路在女性食管ai中促進維持ai癥干細胞樣細胞的動態平衡。發表在JournalofExperimental&ClinicalCancerResearch(IF=5.646)上的一篇文章發現外泌體轉運p-STAT3可促進結直腸ai細胞獲得性5-FU耐藥性。發表在Cancers(IF=6.162)上的一篇文章則研究了腹腔灌洗液中細胞外囊泡相關的miRNA作為子宮內膜ai分子標志物的可能性。此外,在神經系統和精神疾病,中醫學及其他領域也有不少外泌體相關項目中標。外泌體提取試劑直銷價外泌體檢測作為一種新型的液體活檢熱點技術已被許多臨床科研機構普遍地應用于一些病癥和疾病的無創診斷用于外泌體提取的體液收集注意事項:選擇血清還是血漿?推薦大多數研究選擇血漿。廈門外泌體提取試劑廠家
外泌體的提取方法:1.超速離心法(差速離心)。超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎,但過程比較費時,且回收率不穩定(可能與轉子類型有關),純度也受到質疑;此外,重復離心操作還有可能對囊泡造成損害,從而降低其質量。2.密度梯度離心。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感北京外泌體提取試劑產品介紹外泌體提取:小分子可進入凝膠中絕大部分孔洞,在柱中受到更強地滯留,更慢地被洗脫出。

外泌體在肺病進程中的作用:在一些病癥微環境中,一些病癥細胞來源的外泌體能夠誘導CD4+T分化為調節性T細胞,壓制機體的抗一些病癥免疫反應;肺病細胞分泌的外泌體含有miR-21和miR-29a,可在免疫細胞中結合并啟動TLR8,使TLR介導的NF-κB信號通路活化,從而導致一些病癥的生長和轉移。在肺病的侵襲和轉移過程中,細胞間通訊扮演著重要的角色。據有關報道稱,NSCLC分泌的外泌體內TGFβ和IL10的高表達與肺病的轉移密切相關。此外,啟動的T細胞可以通過調控Fas信號通路增加基質金屬蛋白酶9(MMP9)的表達,進而促進肺病的轉移。這些機制有望成為肺病治病的潛在靶點。雖然大多數外泌體都是促進一些病癥的侵襲與轉移,但也有報道稱,外泌體miR-302b可以通過壓制TGFβRⅡ來壓制肺病細胞的轉移與增殖。如純度和回收率低,雜蛋白較多(假陽性),顆粒大小不均一,產生難以去除的聚合物
外泌體相關蛋白質與肺病的診斷:近年來眾多文獻報道,肺病細胞分泌的外泌體中富含多種蛋白質并促進肺病的發生的發展,是早期診斷肺病的有效途徑。有研究發現,NSCLC患者肺組織外泌體表面EGFR免疫染色呈陽性的占80%,而慢性肺炎組織的外泌體EGFR呈陽性的只占2%,因而認為外泌體的EGFR蛋白可以用作NSCLC與慢性肺炎鑒別診斷的生物標志物。Park等通過Sys-BodyFlu-id數據庫分析發現153種特異性胸腔積液外泌體蛋白質,進一步的Westernblotting分析顯示多種特異性胸腔積液外泌體蛋白參與EGFR信號傳導途徑以促進一些病癥的發生的發展,因此外泌體蛋白可能作為肺病診斷篩查的生物學標記物。近幾年來,市場上已出現各種商業化的外泌體提取試劑盒。外泌體提取:重復離心操作還有可能對囊泡造成損害,從而降低其質量。
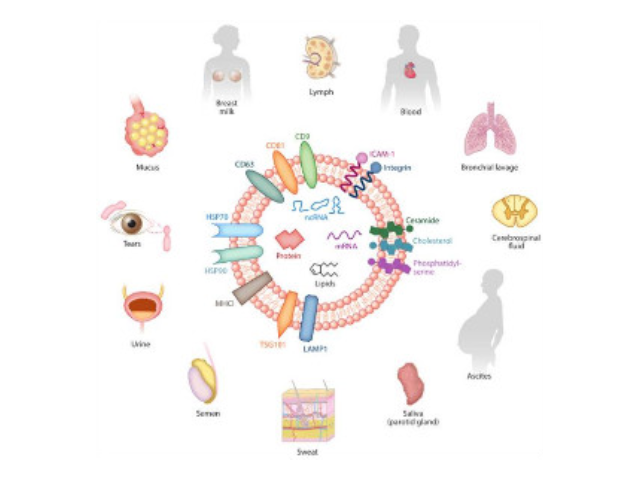
腦組織分離方法簡述:將腦組織剪成薄片,放入離心管中加上消化液進行消化,經水浴、反復輕輕上下顛倒,再用移液間斷緩慢吹吸至消化結束。隨后加入培養基于消化液中,混勻,置于冰上。再進行一系列的差速超速離心過程,包括除雜、濾膜過濾、超離等。較后用PBS重懸外泌體,用重懸后的外泌體進行下面的透射電鏡(TEM)、納米粒徑追蹤分子(NTA)和markerWB鑒定。外泌體(Exosomes)是細胞分泌到胞外的一種囊泡(ExtracellularVesicles,EVs),其大小為30-150nm,具有雙層膜結構和茶托狀形態,含有豐富的內含物(包括核酸、蛋白和脂質等),參與細胞間的分子傳遞。外泌體普遍存在于細胞培養上清以及各種體液中,包括血液、唾液、尿液、、乳汁等,同時也存在于組織樣本中,如腦組織、肌肉組織、脂肪組織等。色譜法。這種方法分離到的外泌體在電鏡下大小均一,但是需要特殊的設備,應用不普遍。重慶正規外泌體提取試劑廠家直銷
一方面可以作為診斷多種疾病的生物指標。廈門外泌體提取試劑廠家
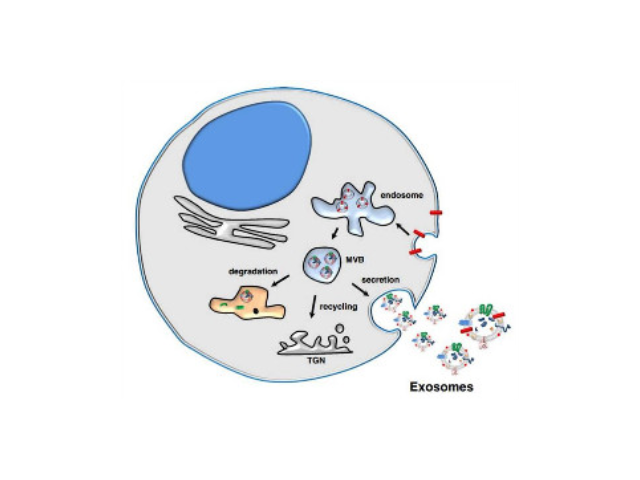
外泌體的形成與鑒定:首先,細胞膜內陷形成一個杯狀結構,包括細胞表面蛋白和與細胞外環境相關的可溶性蛋白,導致早期胞內體(early-sortingendosome,ESE)的從頭形成,或者是杯狀結構直接和已經存在的ESEs融合;trans-高爾基體和內質網也能協助形成ESEs。ESE成熟后形成晚期胞內體(late-sortingendosomes,LSEs),較終形成MVBs(也稱為多囊內小體)。MVBs是通過endosome限制膜向內凹(即質膜雙凹)形成的,這一過程導致MVBs含有多個ILVs。MVB可以與溶酶體或自噬體融合,較終降解或與質膜融合釋放作為外泌體的ILVs。外泌體表面蛋白包括四聚體蛋白、整合蛋白、免疫調節蛋白等。外泌體可以包含不同類型的細胞表面蛋白、細胞內蛋白、RNA、DNA、氨基酸和代謝物。使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后。廈門外泌體提取試劑廠家
- 廈門正規細胞高效轉染試劑銷售廠家 2025-12-19
- 蕪湖正規細胞高效轉染試劑報價 2025-12-19
- 天津如何使用糖原染色試劑盒廠家供應 2025-12-19
- 深圳正規鼠尾膠原生產廠家 2025-12-19
- 江蘇如何使用糖原染色試劑盒廠家供應 2025-12-19
- 徐州鼠尾膠原直銷價 2025-12-19
- 唐山鼠尾膠原哪家便宜 2025-12-19
- 天津正規糖原染色試劑盒產品介紹 2025-12-19
- 石家莊原代細胞分離試劑盒產品介紹 2025-12-19
- 原代細胞分離試劑盒廠家直銷 2025-12-19
- 湖北使用實驗室超純水儀價目表 2025-12-19
- 遼寧國產替代磁芯粘接膠TDS手冊 2025-12-19
- 蕪湖正規細胞高效轉染試劑報價 2025-12-19
- 水性防腐涂料種類 2025-12-19
- 混凝土防腐涂料公司有哪些 2025-12-19
- 長安鎮促裕新材料銷售廠家 2025-12-19
- 湖南耐高低溫工程橡膠液壓系統密封 2025-12-19
- 復配實驗室蒸餾水牌子 2025-12-19
- 北京凸輪軸磷化液的優點 2025-12-19
- 六盤水新型選礦設備耐磨保護應用案例 2025-12-19