廣州正規外泌體提取試劑服務電話
外泌體的提取、分離方法:開發高效、快速、穩定,并且保持外泌體結構和生物功能完整性的方法,是目前外泌體應用于臨床的基礎和前提。從細胞上清和體液中提取分離外泌體的方法很多,但是外泌體的純度和產量卻和分離方法息息相關。通常分離步驟少、產率高,但是純度會受到影響。鑒于每種分離方法都有其優缺點,實驗可以根據樣本來源、下游實驗目的等,選擇合適的外泌體分離方法。2015年,國際囊泡組織(InternationSocietyforExtracelluarVesicles,ISEV)指出,簡單依靠一種分離方法得到的外泌體的純度和產量都難滿足實驗的需求。因此,推薦聯合使用各種方法,從而得到高純度和高產量的外泌體。外泌體提取:樣品中大分子不能進入凝膠孔,只能沿多孔凝膠粒子之間的空隙通過色譜柱,被流動相洗脫出來。廣州正規外泌體提取試劑服務電話
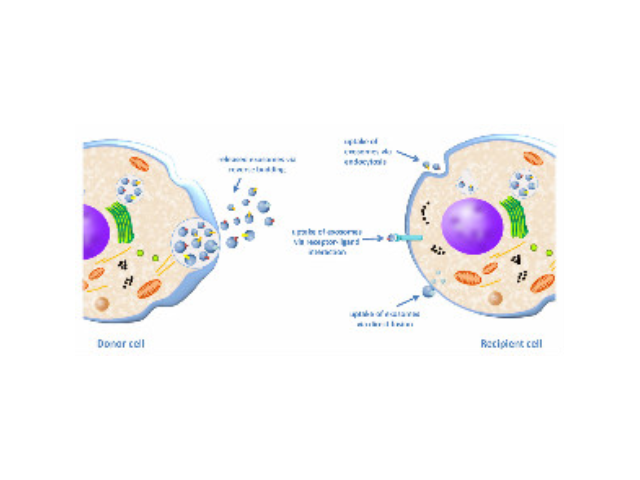
外泌體(Exosome)是細胞主動分泌的囊泡樣小體,大小均一,直徑30-200nm,密度1.10-1.18g/ml,來源普遍,幾乎所有細胞都可分泌,在血液,尿液,唾液,腦脊液,腹水,乳汁等體液中普遍分布。外泌體較早在1986年發現于培養的綿羊紅細胞上清液中。1996年,研究者發現外泌體作為抗原呈遞因子參與T細胞依賴的抗一些病癥反應,開啟了外泌體蛋白研究的新天地。2013年諾貝爾生物/醫學獎解答了細胞如何組織其內部較重要的運輸系統之一——囊泡傳輸系統的奧秘。外泌體提取試劑廠家是一種用于一些病癥診斷和預后監測的非常理想的新型生物標記物一些疾病的早期診斷。
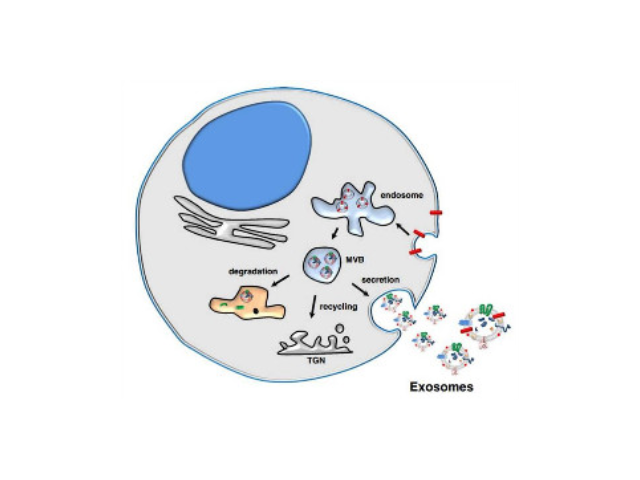
外泌體的提取方法學規范、統一定量及鑒定等。關于外泌體的提取有超速離心、試劑盒、超濾法、蔗糖密度梯度離心等,然而各種方法均有其利弊。超速離心法是目前外泌體相關文章中的主流方法,由于離心步驟繁瑣,費事費力,而且步驟多導致實驗中容易污染,且損耗量大,使得較終回收的外泌體不穩定。而且對于抽提細胞上清來說,更是極為不請便,試想用提取300ml的上清需要6個50ml離心管,無論是過濾還是后續的每一步的離心去沉淀,都具有操作極其不便的缺點,總之非常麻煩。而超濾法存在外泌體會堵塞膜孔,造成濃縮效率低,濃縮管重復利用差,甚至堵塞在膜孔的外泌體還可能會粘連成團,造成損失及較后的數據有誤差,對于后續實驗也有影響。
用于外泌體提取的體液收集注意事項:1、選擇血清還是血漿?推薦大多數研究選擇血漿。血液凝固過程中血小板會產生大量外泌體,含量占血清中外泌體的50%以上,選擇血漿可避免不必要的影響。2、注意抗凝劑的選擇。肝素類抗凝劑與PCR假陰性有關,這可能是因為肝素與引物和/或酶有競爭作用。除了克制PCR,肝素可以與外泌體結合,阻止細胞攝取外泌體。因此需要記錄肝素類藥物的患者的血液樣本。EDTA和雙嘧達莫(CTAD),CTAD可以阻止血小板的并克制其釋放外泌體。EDTA可能會干擾PCR反應(盡管其程度小于肝素),但是還是優于其他選擇。此外,有研究表明鈣螯合劑可在體外促進外泌體與血小板的結合從而降低經EDTA、或檸檬酸鹽處理后的血液樣本中外泌體的表觀數量。使用肝素時這種影響就不會發生,因此建議在測量外泌體的精確數量時選用肝素。但是也有研究表明肝素可以導致體外條件下外泌體的減少。總之,目前尚需要更多的研究論證抗凝劑是否及如何對外泌體的釋放,作用和下游反應產生特異性影響。無法實現臨床的常規化應用。
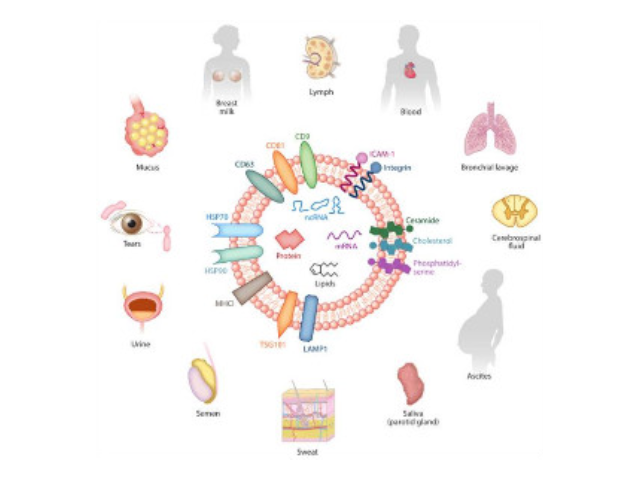
外泌體鑒定:外泌體分離之后,需要經過一系列鑒定才能確定分離的是外泌體。鑒定方法從物理特征到表面分子標志物,多角度進行鑒定。l透射電鏡鑒定法:簡稱TEM,適合外泌體雙層囊膜超微結構觀察,即通常為茶托型或一側凹陷的半球形。l納米顆粒追蹤分析法:簡稱NTA,該方法能保證外泌體原始狀態、檢測速度快,檢測后能提供外泌體粒徑和濃度信息。lWesternblot分子標志物檢測:外泌體標志蛋白包括四跨膜蛋白家族,如CD9、CD63和CD81;細胞質蛋白,如肌動蛋白(Actin)和鈣磷脂結合蛋白(Annexins);使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后。超離法因操作簡單,獲得的囊泡數量較多而廣受?歡迎,但過程比較費時,且回收率不穩定,純度也受到質疑。武漢外泌體提取試劑廠家現貨
外泌體提取:用這種聚合物沉淀具有許多優點,包括對分離的外泌體影響小、pH中性等。廣州正規外泌體提取試劑服務電話
研究探討了外泌體是否可以作為RNAi的有效載體的可能性。與脂質體和其他合成藥物納米顆粒載體不同,外泌體含有可能增強內吞作用的跨膜和膜錨定蛋白,從而促進其內容物的遞送。CD47是外泌體蛋白質之一,是一個普遍表達的整合素相關跨膜蛋白,其部分功能可以保護細胞免受吞噬作用。CD47是信號調節蛋白α(SIRPα,也稱為CD172a)的配體,CD47-SIRPα間的結合能夠發出“不要吃我”的信號,從而壓制吞噬作用。病基因RAS能夠促進胰腺病細胞增殖,增強胞飲作用從而促進一些病癥細胞攝取外泌體。合成納米顆粒對細胞有一定毒性作用,但使用外泌體能夠較小化對細胞的毒性。研究人員發現,CD47和病基因KRAS驅動的胞飲作用都會壓制外泌體被循環系統的清理,并增強胰腺病細胞對外泌體的特異性。所以,外泌體的這種特性增強了它們通過遞送RNAi來特異性靶向胰腺病中的KRAS的能力,并且使用外泌體作為單一靶向劑顯著改善了所有實驗PDAC小鼠模型的總生存期。廣州正規外泌體提取試劑服務電話
- 山東品牌糖原染色試劑盒廠家直銷 2025-12-19
- 青島正規原代細胞分離試劑盒直銷廠家 2025-12-18
- 唐山正規鼠尾膠原哪里買 2025-12-18
- 無錫昆明細胞高效轉染試劑 2025-12-18
- 珠海細胞高效轉染試劑廠家供應 2025-12-18
- 天津正規細胞高效轉染試劑哪家好 2025-12-18
- 無錫天津細胞高效轉染試劑 2025-12-18
- 青島細胞高效轉染試劑服務電話 2025-12-18
- 金華鼠尾膠原直銷價 2025-12-18
- 溫州正規細胞高效轉染試劑進貨價 2025-12-18
- 安徽動態冰蓄冷適用范圍 2025-12-19
- 石油管道防腐涂料定做 2025-12-19
- 烏魯木齊了解防腐漆型號 2025-12-19
- 溫州濕式氧化蒸發器清洗服務哪家好 2025-12-19
- 北京普遍使用實驗室超純水儀價目表 2025-12-19
- 家電組裝導熱粘接膠小批量定制 2025-12-19
- 云南誠信的鍍鎳大概價格多少 2025-12-19
- 拉伸強度強工程橡膠新能源汽車電機防水 2025-12-19
- 河南邵氏硬度高工程橡膠橋梁隔震支座 2025-12-19
- 黑龍江修護護膚品好用 2025-12-19